【不对称催化】
拼译:asymmetric catalysis
手征性是区分生命物质与非生命物质的主要标志。生物体内蛋白质肽链的严密结构要求生物活性物质必须在空间结构上与其匹配才能充分显示生理活性。因此这些手性物质必须具有特定空间构型,其对映体常无活性甚至有截然相反的性能。长期以来人们只能从生物体提取手性物;用生物酶制备手性物质;或从一种天然手性物制备另一种手性物质。用普通化学方法只能得到两种或多种对映体含量相等的外消旋体,需经拆分方可得到旋光物质,操作繁琐资源浪费。化学计量不对称合成可得手性产物,但要消耗大量手性试剂或辅助试剂。不对称催化的出现开辟了制备手性产物新途径,仅用少量手性催化剂即可将大量前手性(Prochiral)底物对映体选择性地转化为手性(Chiral)产物。
不对称催化又叫催化不对称合成或手性催化,是催化和有机合成中一个新的分支。它充分发挥了络合催化高选择性优点,达到对映体选择性催化。1966年Nozaki首次用铜-手性席夫碱实现不对称环丙烷化反应。1968年Horner和Knowles几乎同时将手性膦引入了Wilkinson催化剂RhCl(PPh3)3,实现不对称氢化反应。自那时起不对称催化从无到有迅速发展。已合成几百种手性配体,研究了几十种反应。并已获得工业应用。1986年第1本不对称催化专著问世,不对称合成丛书也出版了手性催化专集。不对称催化剂的光学选择性主要来源于催化剂特别是配体与底物的空间相互作用,因此合成高选择性手性配体成为不对称催化首要任务。起初认为手性中心应尽量靠近催化剂的金属原子,因此合成了手性磷原子配体,如P*MePrPh即MPPP等。合成中必须经过拆分才能得到这类手性配体,所以合成较难。后来研究表明,手性中心在膦配体取代基的碳原子上同样有光学选择性。1971年Morrison第1次合成了带手性碳的膦配体,标志着不对称催化前进了一大步,从此可以用便宜易得的天然手性化合物,如酒石酸、樟脑、薄荷醇、氨基酸、糖类等,作为原料合成各种手性配体。首先合成了手性碳原子单膦配体甲基 基苯基膦MMPP等。单膦配体制成过渡金属络合物催化剂构型易变,光学选择性不高,故转向合成手性双膦配体。Kagan等首先以酒石酸为原料合成了双膦配体DIOP,其他学者从乳酸合成了PROPHOS,从2,3-丁二醇制得CHIRAPHOS,从1,3-丁二醇制得CHAIRPHOS等。后来合成了PNNP型双胺膦配体,既有手性中心又有手性面的二茂铁型配体BPPFA,由于旋转受阻而产生手性轴的联萘配体BINAP等,都表现出很高的光学选择性。不对称催化研究已遍及所有重要反应,研究最多的是氢化反应,α-酰氨基丙烯酸衍生物常作为通用底物用于评价各催化体系的光学选择性。底物烯烃上电负性取代,可与催化剂形成第二个配位键,有利于提高光学选择性,Z式异构体优于E式。综合反应络合物X-射线分析,低温31P、13C-NMR谱数据及动力学研究,Halpern基于结构差异提出了动力学控制对映体选择性的机理,当R、S二对映体活化自由能之差△△G≠=12kJ/mol时,光学选择性可达99%ee.各类不对称催化反应已达到的光学选择性见表1。
基苯基膦MMPP等。单膦配体制成过渡金属络合物催化剂构型易变,光学选择性不高,故转向合成手性双膦配体。Kagan等首先以酒石酸为原料合成了双膦配体DIOP,其他学者从乳酸合成了PROPHOS,从2,3-丁二醇制得CHIRAPHOS,从1,3-丁二醇制得CHAIRPHOS等。后来合成了PNNP型双胺膦配体,既有手性中心又有手性面的二茂铁型配体BPPFA,由于旋转受阻而产生手性轴的联萘配体BINAP等,都表现出很高的光学选择性。不对称催化研究已遍及所有重要反应,研究最多的是氢化反应,α-酰氨基丙烯酸衍生物常作为通用底物用于评价各催化体系的光学选择性。底物烯烃上电负性取代,可与催化剂形成第二个配位键,有利于提高光学选择性,Z式异构体优于E式。综合反应络合物X-射线分析,低温31P、13C-NMR谱数据及动力学研究,Halpern基于结构差异提出了动力学控制对映体选择性的机理,当R、S二对映体活化自由能之差△△G≠=12kJ/mol时,光学选择性可达99%ee.各类不对称催化反应已达到的光学选择性见表1。表1 不对称催化反应
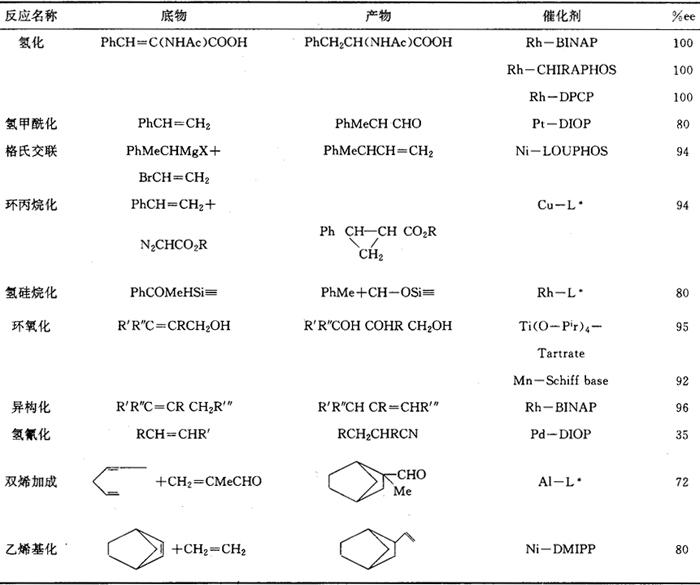
表2 不对称催化工业应用
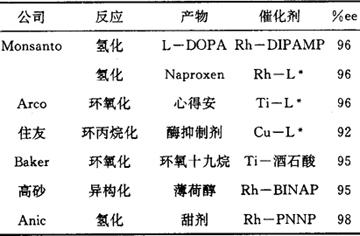
(中国科学院大连化学物理研究所杨振云研究员撰)