【我国蔬菜原生质体培养】
拼译:advances in protoplast culture ofvegetable crops in China
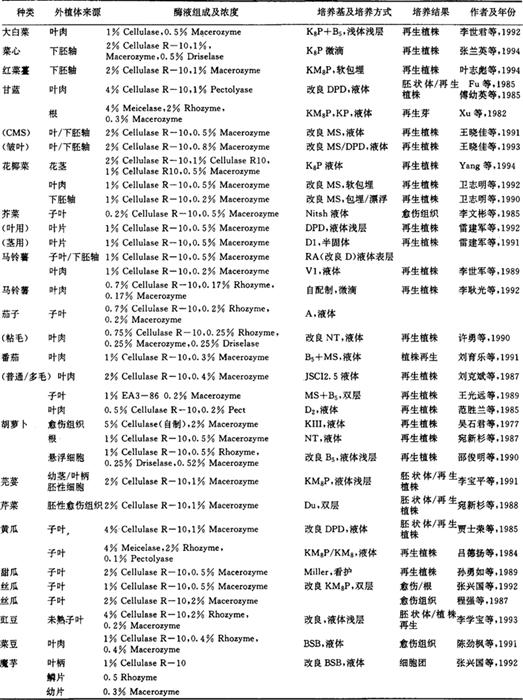
蔬菜原生质体培养在我国已取得了较大的进展。茄科的番茄、茄子、马铃薯,葫芦科的黄瓜、甜瓜、伞形花科的胡萝卜、芹菜、芫荽以及百合科的洋葱等均有原生质体培养成株的报道。十字花科芸薹属染色体C组的甘蓝类研究较多,如甘蓝和花椰菜,还有AB组的芥菜,尤其是植株再生相当困难的A组的大白菜、红菜薹、菜心以及豆科的豇豆等原生质体均相继培养成功。使我国蔬菜原生质体培养技术达到世界先进水平。
供试外植体材料的选择 外植体来源是原生质体培养成功与否的一个重要限制因子,也是原生质体培养研究首先碰到的第1个问题。与其它作物一样,蔬菜的原生质体游离及以后培养,不同的基因型存在明显的差异。不同基因型的相同外植体对培养基的反应很不相同,对外植体来源的选择应有基因型、器官和组织及其特定的生长条件等差异。基因型对原生质体的游离和培养的影响是很明显的,从红菜薹原生质体培养中看到十月红1号的原生质体在KM8P上可进行分裂和再生,十月红2号则不能。花椰菜不同熟性的品种,原生质体培养的结果相差很大,表现出早熟品种优于中熟和晚熟品种,晚熟品种表现最差。在相同的培养基和培养条件下,洋葱黄皮品种比红皮品种的原生质体反应要好。同样,大白菜城青2号品种比高脚白的原生质体的分裂频率高3倍。王光远等(1991)用番茄21个品种和F1代游离的原生质体进行培养,其中只有1个品种有分化。这表明适当选择不同品种或F1作起始材料,对培养成功与否是重要的。同一种蔬菜作物不同类型来源的外植体所游离的原生质体的产率及在培养过程中的反应不尽相同。戴朝曦等(1994)用3个马铃薯品种的下胚轴分离原生质体平均产量为26.8×105/g.f.wt,子叶的低76%。在甘蓝中,叶肉原生质体培养了3~4d才有分裂,而下胚轴在48h就启动分裂,5d即行第2次分裂。番茄从.无菌苗游离的原生质体易培养成活和分裂,而田间苗正好相反,原生质体不分裂。同样在魔芋中,根尖原生质体不分裂,幼叶和鳞片的则能分裂。一般以无菌苗下胚轴原生质体培养相对容易成功。许多研究者对同一外植体不同苗龄或不同生理状态的原生质体作了比较研究。豇豆未成熟子叶生理状态直接影响游离原生质体数量和质量,过嫩的不能游离原生质体,过老则细胞内淀粉粒多,造成原生质体解体死亡。番茄3~4周无菌苗比30d老苗的原生质体产率高,质量好,分裂快。在花椰菜中也是如此,以7~10d苗原生质体产率高,易生壁,持续分裂能力强。但是,同为甘蓝种的皱叶甘蓝则以3d苗下胚轴分裂原生质体好,比5d苗的产量高8倍多,分裂频率达9.0%,5d苗龄的分裂频率为3.5%,7d的仅0.5%.9d苗龄的原生质体就不分裂了。马铃薯6周老苗难游离出原生质体,但3d以下的苗太嫩,原生质体易破裂,4周的苗最适合游离。外植体生长的环境条件也影响原生质体的产率和分裂频率。如丝瓜、马铃薯和茄子等,进行原生质体游离时发现外植体材料在较强光照下生长的优于生长在暗光或弱光下的,在3000lx光照强度下,3个马铃薯品系平均原生质体产率为19.9×105/g.f.wt,1000lx只有11.7×105/g.f.wt,黑暗下的仅有0.8×105/g.f.wt,经1周培养细胞分裂频率差异更大,强光照的幼苗原生质体为45.2%,弱光下为33.1%,黑暗下的为0。花椰菜在21℃下生长的无菌苗比25℃和28℃的原生质体活力高,28℃最差。首先建立起植物的胚性细胞系,然后再游离原生质体,这一方法在那些原生质体较难再生的农作物中已有成功经验。在黄瓜和伞形花科蔬菜中也表现出同样好的效果。只是建立起该系统需较长的时间和周期。借鉴花粉培养中低温预处理方法对要游离原生质体的外植体进行低温预处理也收到一定效果。酶液的影响 植物原生质体游离酶的组成一般没有多大差别,主要是纤维素酶和果胶酶,有时再加入半纤维素酶,如用纯度高的酶制剂则游离速度快,需要时间短。就酶的浓度,纤维酶1%~2%,果胶酶0.5%~1%,浓度过低,去壁率低,影响原生质体分裂;浓度高则有毒性,造成破裂多,产率低,褐化严重,分裂频率低。如甘蓝叶肉原生质体就是如此。在改进原生质体游离质量中,常用Ca2+或甘露醇等渗透稳定剂或加入MES作H+浓度稳定剂和小牛血清蛋白等均能改善原生质体的质量。培养基的影响 原生质体是去壁的裸露细胞,培养基中各种物质成分直接与原生质膜接触,因此培养基中成分种类及浓度对原生质体有强裂的影响。在蔬菜原生质体培养中,普遍使用的是KM8P或K8P,此外,改良的DPD、B5、NT和Du培养基应用也较普遍。有些蔬菜(如胡萝卜)原生质体对培养基有较广的适应性。同样花椰菜叶肉原生质体既可在KM8P又可在MS培养基上培养和分裂。但有时富含营养的培养基(如KM8P)并不一定优于较简单的培养基(如MS)。结球甘蓝和皱叶甘蓝叶肉和下胚轴原生质体均在改良的MS培养基上启动快,分裂快。豇豆未成熟子叶原生质体在改良的MS培养基上比在KM8P和B5上的存活率和分裂频率高。甚至黄瓜原生质体在1/2MS培养基上胚状体也大量发生。可见,从实验操作上看,适当简化培养基组成,以增加可操作性和重演性是必要的。在原生质体培养中,褐化是常见的,褐化原因固然很多,其中培养基种类或组成是主要的方面。芹菜原生质体在Du培养基上就褐化慢,在MS上次之,在NT中褐化最严重。 对原生质体有毒害作用,通常用
对原生质体有毒害作用,通常用 代替N源,收到一定效果。在甘蓝中,经改良的MS培养基减少了
代替N源,收到一定效果。在甘蓝中,经改良的MS培养基减少了 ,增加了NO2+,改善了原生质体稳定性,有利于早期分裂。丝瓜亦是如此。但也有特殊的情况,在马铃薯叶肉原生质体培养基中,初期
,增加了NO2+,改善了原生质体稳定性,有利于早期分裂。丝瓜亦是如此。但也有特殊的情况,在马铃薯叶肉原生质体培养基中,初期 尽管使细胞分裂频率有所下降,但提高了愈伤组织的形成。糖在培养基中既作碳源又是渗透稳定剂,在原生质体培养中,一般用葡萄糖、甘露醇或山梨醇,蔗糖多作配合使用。提高蔗糖浓度,尽管有使甘蓝叶肉原生质体漂浮在液体培养基的表面减缓褐化的报道,但是培养基中高浓度的蔗糖对原生质体多有不利影响,易发生细胞褐化。在原生质体培养基中附加激素是必要的,常用的生长素为2,4-D。在菜心和甘蓝中,用NAA代替2,4-D有利于原生质体的分化,提高生长速率。可见,NAA对芸薹属蔬菜原生质体生成愈伤组织是重要的。原生质体培养方法及技术 原生质体经纯化后即可进行培养,培养方法有液体培养和固体培养及二者的改进培养方法。在蔬菜原生质体培养中,大多用液体浅层培养,以改善透气性,便于观察和培养基的添加,但是原生质体沉淀和褐化仍有发生。目前发展的琼脂糖软包埋法和用Gelrite包埋法,既可防止原生质体的聚集又在一定程度上增加了透气性,也降低了用于包埋的琼脂糖中含硫杂质对细胞的毒害性,从而提高了细胞分裂能力。防止原生质体的褐变是组织培养成功的关键。除前面所述的外植体的影响外,还有许多因子造原生质体的褐化。沉淀或聚集的原生质体通常发生褐变,其原因多用通气性不良解释。在液体培养法中,这种现象确实普遍存在,互相影响,聚集沉淀导致褐变,褐化的细胞释放出酚类物质,进而氧化成醌类化合物,使聚在一起的原生质体或细胞团加快死亡,这种现象在芸薹属植物中表现尤为明显。对此,我国科技工作者做了较多的探索,培养方法有双层培养、液体浅层培养、微滴培养以及看护培养等。王光远等(1989)在番茄子叶原生质体培养基的比较试验结果说明了一些因子与褐变的关系。在液体培养基上,原生质体褐变率达47%,分裂频率为0;固体培养基上,原生质体褐变率为28%,分裂频率为0.02%~0.25%;用双层培养,原生质体褐变率只有12%,分裂频率为4%~6.15%。在培养基中添加Vc、PVP、硫代硫酸钠,或多胺等物质,以抑制酚类或乙烯形成,促进细胞分裂,控制褐变均收到一定效果。此外,附加活性碳在一定程度上也可缓解褐变。但是,这些物质的作用机理尚缺乏深入研究。在菜豆和魔芋原生质体液体培养时,尽管培养基中加入了PVP或Vc,减轻了褐化程度,但是细胞内液胞中多酚仍有累积,细胞分裂仍然受到了抑制。可见,简单地添加某种物质似乎还不足以解决细胞内有毒物质的自我累积问题。有一种补救的办法,就是不时地将液体培养的原生质体放在慢速摇动(10~30r/min)的摇床上摇动,以改善通气性,这在甘蓝等上已证明是较为有效的方法。培养在原生质体培养过程中会逐渐酸化,H+浓度上升,李世君等(1992)用新鲜的H+浓度为316nmol/L的培养基补加,以调回到原有的H+浓度水平。这一方法在一定程度上减少了褐变发生。原生质体形成细胞团后尽早转移到新鲜的或半固体培养基上,可防止褐变扩大化,这在红菜薹和菜心原生质体培养中表现尤为明显。而且延长培养和继代时间长,都会使细胞团分化能力丧失。可见必须适时转或诱导培养物分化。
尽管使细胞分裂频率有所下降,但提高了愈伤组织的形成。糖在培养基中既作碳源又是渗透稳定剂,在原生质体培养中,一般用葡萄糖、甘露醇或山梨醇,蔗糖多作配合使用。提高蔗糖浓度,尽管有使甘蓝叶肉原生质体漂浮在液体培养基的表面减缓褐化的报道,但是培养基中高浓度的蔗糖对原生质体多有不利影响,易发生细胞褐化。在原生质体培养基中附加激素是必要的,常用的生长素为2,4-D。在菜心和甘蓝中,用NAA代替2,4-D有利于原生质体的分化,提高生长速率。可见,NAA对芸薹属蔬菜原生质体生成愈伤组织是重要的。原生质体培养方法及技术 原生质体经纯化后即可进行培养,培养方法有液体培养和固体培养及二者的改进培养方法。在蔬菜原生质体培养中,大多用液体浅层培养,以改善透气性,便于观察和培养基的添加,但是原生质体沉淀和褐化仍有发生。目前发展的琼脂糖软包埋法和用Gelrite包埋法,既可防止原生质体的聚集又在一定程度上增加了透气性,也降低了用于包埋的琼脂糖中含硫杂质对细胞的毒害性,从而提高了细胞分裂能力。防止原生质体的褐变是组织培养成功的关键。除前面所述的外植体的影响外,还有许多因子造原生质体的褐化。沉淀或聚集的原生质体通常发生褐变,其原因多用通气性不良解释。在液体培养法中,这种现象确实普遍存在,互相影响,聚集沉淀导致褐变,褐化的细胞释放出酚类物质,进而氧化成醌类化合物,使聚在一起的原生质体或细胞团加快死亡,这种现象在芸薹属植物中表现尤为明显。对此,我国科技工作者做了较多的探索,培养方法有双层培养、液体浅层培养、微滴培养以及看护培养等。王光远等(1989)在番茄子叶原生质体培养基的比较试验结果说明了一些因子与褐变的关系。在液体培养基上,原生质体褐变率达47%,分裂频率为0;固体培养基上,原生质体褐变率为28%,分裂频率为0.02%~0.25%;用双层培养,原生质体褐变率只有12%,分裂频率为4%~6.15%。在培养基中添加Vc、PVP、硫代硫酸钠,或多胺等物质,以抑制酚类或乙烯形成,促进细胞分裂,控制褐变均收到一定效果。此外,附加活性碳在一定程度上也可缓解褐变。但是,这些物质的作用机理尚缺乏深入研究。在菜豆和魔芋原生质体液体培养时,尽管培养基中加入了PVP或Vc,减轻了褐化程度,但是细胞内液胞中多酚仍有累积,细胞分裂仍然受到了抑制。可见,简单地添加某种物质似乎还不足以解决细胞内有毒物质的自我累积问题。有一种补救的办法,就是不时地将液体培养的原生质体放在慢速摇动(10~30r/min)的摇床上摇动,以改善通气性,这在甘蓝等上已证明是较为有效的方法。培养在原生质体培养过程中会逐渐酸化,H+浓度上升,李世君等(1992)用新鲜的H+浓度为316nmol/L的培养基补加,以调回到原有的H+浓度水平。这一方法在一定程度上减少了褐变发生。原生质体形成细胞团后尽早转移到新鲜的或半固体培养基上,可防止褐变扩大化,这在红菜薹和菜心原生质体培养中表现尤为明显。而且延长培养和继代时间长,都会使细胞团分化能力丧失。可见必须适时转或诱导培养物分化。表1 我国蔬菜原生质体培养简表
(华中农业大学叶志彪撰)